Monitoraggio del flusso sanguigno cerebrale
![]()
PSI per il monitoraggio del flusso sanguigno cerebrale
L’esclusiva combinazione di una risoluzione spaziale elevata, un ampio campo visivo e un elevato frame rate rende PeriCam PSI lo strumento ideale per immagini cerebrali di alta qualità e monitoraggio di variazioni rapide.
Le variazioni del flusso ematico cerebrale (CBF) sono una caratteristica di diverse condizioni neurologiche e, pertanto, il centro di diversi studi nei campi delle neuroscienze. Questi studi richiedono strumenti per investigare tali variazioni, preferibilmente tramite metodi non invasivi, in tempo reale. PeriCam PSI System è un imager a perfusione sanguigna basato su tecnologia di analisi con contrasto laser speckle (LASCA). LASCA fornisce nuovi mezzi per analizzare la microcircolazione in modi impossibili in passato. Consente la visualizzazione della perfusione sanguigna dei tessuti in tempo reale e combina una risposta dinamica alla risoluzione spaziale. Non c’è influenza sulla perfusione, in quanto non è necessario alcun contatto diretto sul tessuto, né mezzi di contrasto o oligoelementi. Per migliorarne ulteriormente la fruibilità, è stato sviluppato un software applicativo dedicato, PIMSoft. Il sistema PSI è stato utilizzato ampiamente per monitorare il CBF e le modifiche al CBF in più modelli murini per descrivere la patologia e monitorare l’efficacia del trattamento.
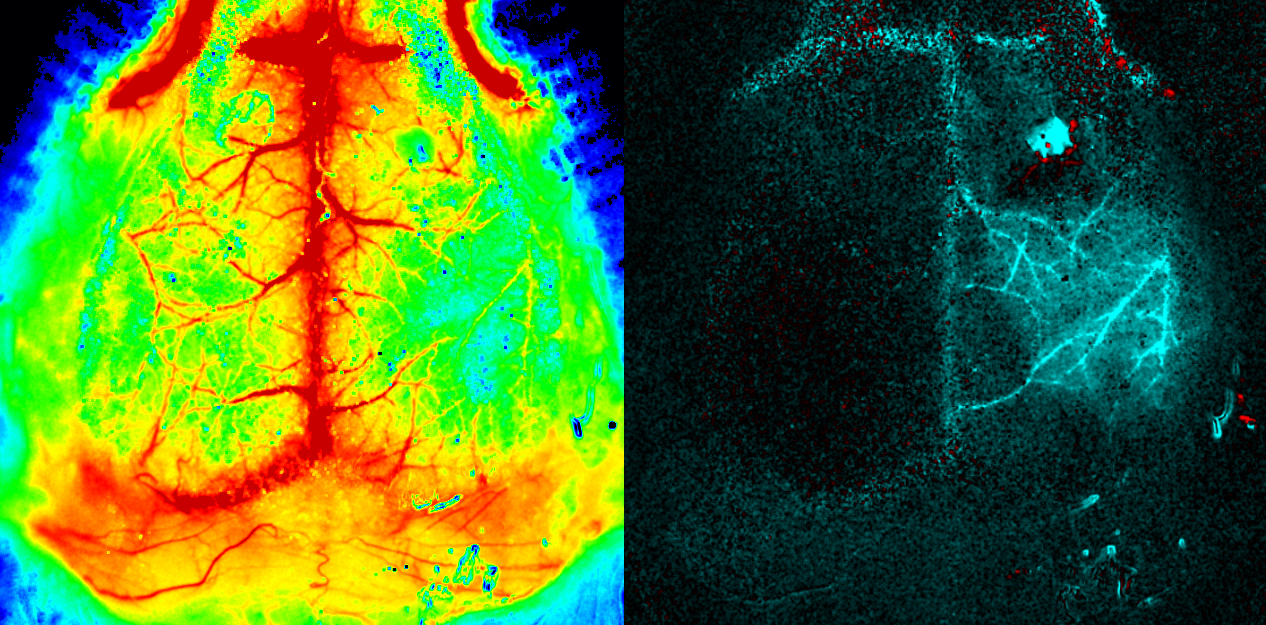
Cervello del topo. PeriCam PSI HR (High Resolution). Per gentile concessione del dott. Offenhauser, Charité, Berlin, Germany.
Panoramica
È stato provato che PeriCam PSI è uno strumento utile in un’ampia gamma di campi nell’area della ricerca
sul flusso ematico cerebrale. Uno dei principali campi di ricerca è rappresentato dalle lesioni cerebrali ischemiche. L’ictus ischemico ed emorragico possono essere indotti e l’entità degli stessi può essere determinata utilizzando PeriCam PSI, mentre il processo dinamico dopo l’ictus può essere seguito nel tempo. Analogamente, i modelli di ipoperfusione cerebrale cronica e lesione cerebrale traumatica sono idonei all’analisi mediante PeriCam PSI.
Un altro campo riguarda lo studio delle variazioni emodinamiche cerebrali, in cui la combinazione della risoluzione spaziale elevata, l’ampio campo visivo e l’elevato frame rate rendono PeriCam PSI lo strumento ideale per analizzare rapidi cambiamenti del CBF. La tecnica si adatta perfettamente alla visualizzazione delle onde delle variazioni di perfusione che si verificano durante la depolarizzazione corticale propagata e la modalità di immagine con differenza è stata sviluppata tenendo conto di questa applicazione. Più recentemente, è stato provato che l’accoppiamento neurovascolare è un’applicazione adatta a questa tecnica.
PSI per la caratterizzazione di lesioni cerebrali ischemiche
Le esclusive funzionalità qualificano il sistema PSI per l’analisi di lesioni cerebrali ischemiche in diversi modelli, tra cui ictus, ipoperfusione cerebrale cronica e lesioni cerebrali traumatiche.
Ampio campo visivo: la visualizzazione dell’intera area cerebrale consente la conferma e la caratterizzazione della lesione ischemica
Elevata risoluzione spaziale: fornisce i punti precisi della lesione. L’inserimento di aree di interesse (ROI) consente la misurazione dell’area della lesione e possono essere utilizzate per monitorare il recupero della lesione.
Riepilogo della funzione di registrazione: semplifica l’acquisizione dei dati e l’analisi di studi longitudinali acquisendo misurazioni ripetute dello stesso soggetto in un singolo file e consentendo un semplice confronto delle stesse ROI nel tempo.
Modello di ictus
o occlusione dell’arteria cerebrale media (MCAO) – Un filamento viene inserito nell’arteria per occludere il flusso ematico per un periodo di tempo fisso (circa 30-120 minuti) prima che la rimozione per riperfusione causi un ictus ischemico 1-9.
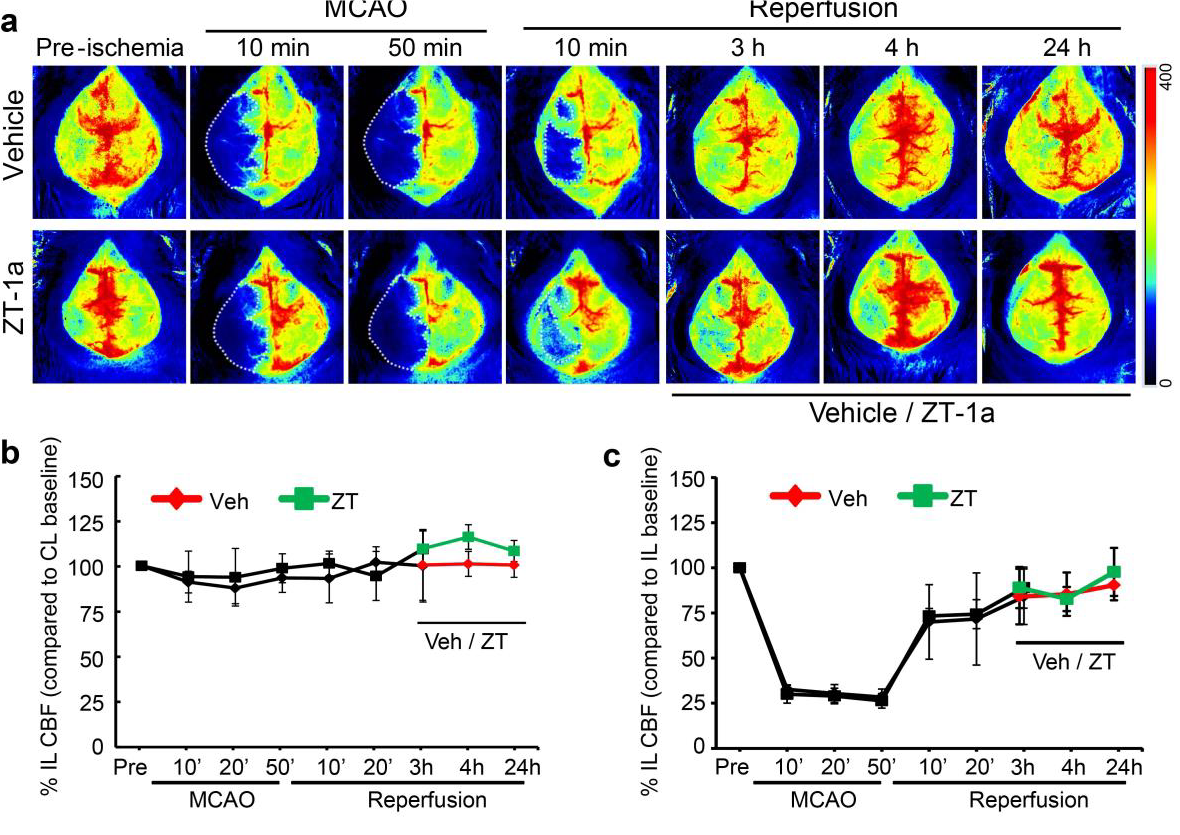
Immagini di perfusione del cervello di un topo, prima, durante e dopo la MCAO con variazioni quantificate nella perfusione sanguigna dei lati ipsilaterale e controlaterale sia per gli animali trattati sia per gli animali non trattati.
Per gentile concessione di Dandan Sun e Iqbal H. Bhuiyan, Department of Neurology and Pittsburgh Institute For Neurodegenerative Diseases, University of Pittsburgh. Figura riprodotta con l’autorizzazione di Nature Communications, originariamente pubblicato in: Zhang, J., Bhuiyan, M.I.H., Zhang, T. et al. Modulation of brain cation-Cl− cotransport via the SPAK kinase inhibitor ZT-1a. Nat Commun 11, 78 (2020). doi: 10.1038/s41467-019-13851-6
o Modello di emorragie subaracnoidee (SAH) – Il filamento viene inserito per perforare l’arteria cerebrale anteriore causando un ictus 10-13.
Brain Research 1727 (2020) 146566
Immagini della perfusione del cervello di un topo prima e dopo una lesione SAH. Lo stesso animale è stato seguito per una settimana dopo la lesione con lo scopo di valutarne il recupero. Immagini acquisite con PSI HR.
Ipoperfusione cerebrale cronica
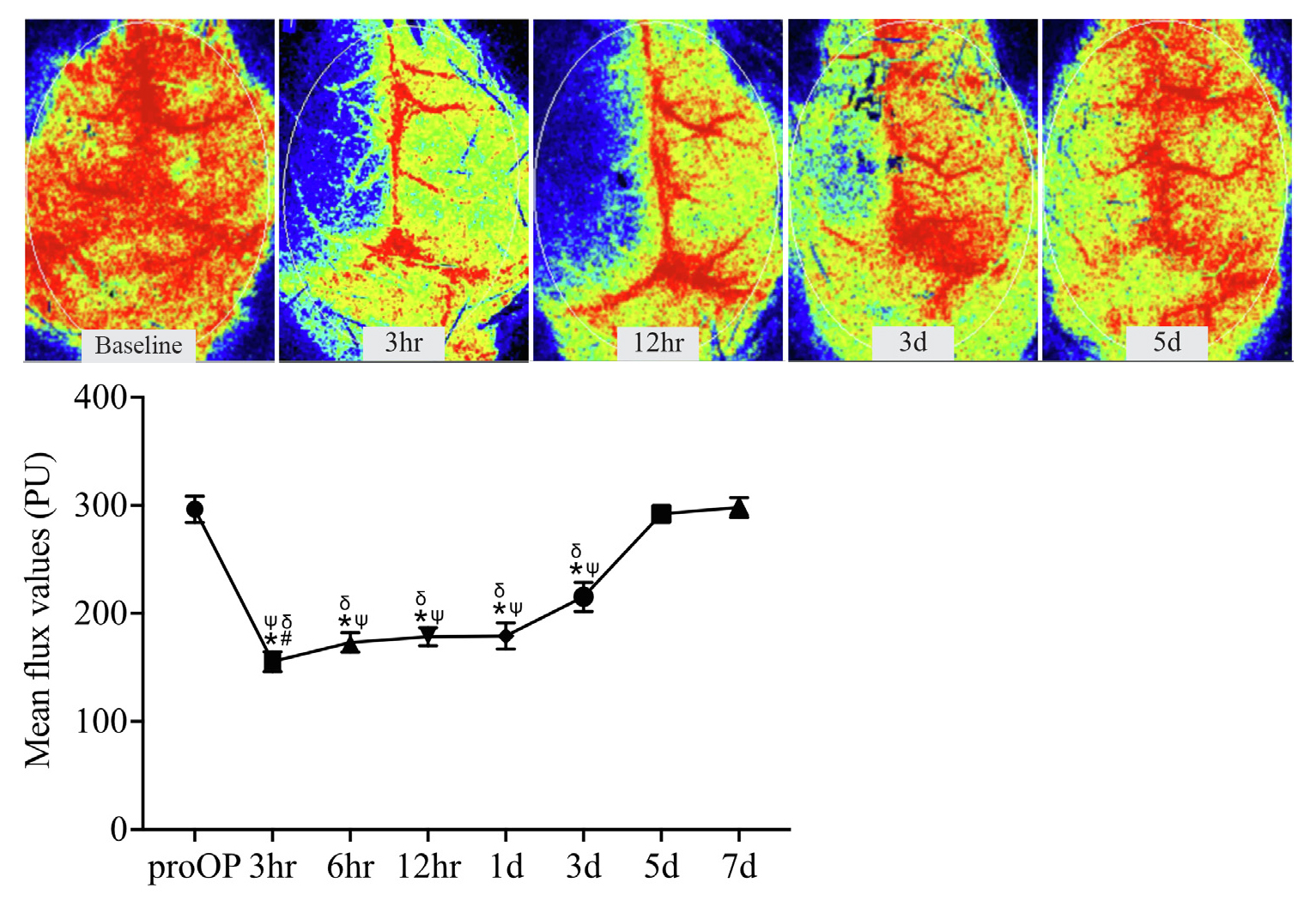
o Modello di occlusione dell’arteria carotidea comune bilaterale (BCCAO) – Le arterie carotidi comuni vengono legate in maniera doppia e ben salda utilizzando suture o microcoil per creare regioni ischemiche in entrambi gli emisferi 14-20.
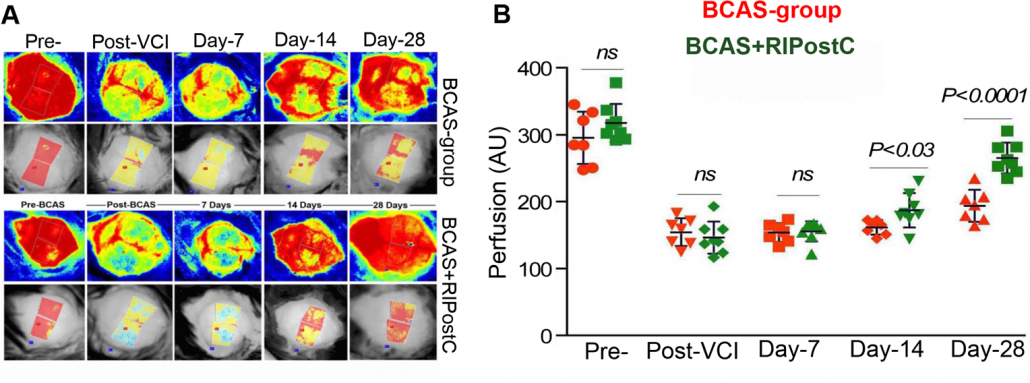
Immagini di perfusione del cervello di un topo, prima e dopo la lesione BCCAO con variazioni quantificate nella perfusione sanguigna sia per gli animali trattati sia per gli animali non trattati. Gli animali sono stati seguiti per un mese dopo la lesione.
Per gentile concessione del dott. Nasrul Hoda Georgia Regents University, University of Georgia, e Charlie Norwood VA Medical Center, Augusta, GA.
Figura riprodotta con l’autorizzazione di Translational Stroke Research e originariamente pubblicata in: Khan, M.B., Hoda, M.N., Vaibhav, K. et al. Remote Ischemic Postconditioning: Harnessing Endogenous Protection in a Murine Model of Vascular Cognitive Impairment. Transl. Stroke Res. 6, 69–77 (2015). https://doi.org/10.1007/s12975-014-0374-6.
Lesione cerebrale traumatica
o Modello di impatto corticale controllato (CCI) – Dispositivo per contusioni utilizzato per creare lesioni controllate sulla corteccia sensomotoria 21-23.
o Modello di accelerazione caduta/impatto peso – Un peso viene lasciato cadere sul cranio non protetto per creare una lesione cerebrale.
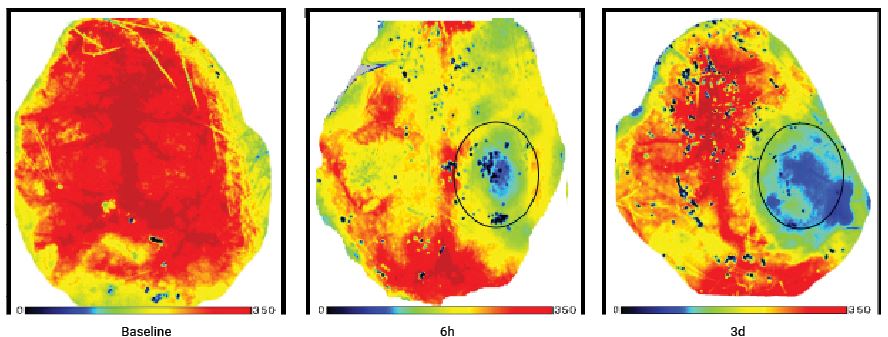
Immagini di perfusione del cervello di un topo prima e dopo una lesione cerebrale traumatica. Lo stesso animale è stato seguito per 3 giorni dopo la lesione.
Per gentile concessione del dott. Han Liu Department of Neurosurgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, PR China
H. Liu et al./Brain Research 1700 (2018) 118–125
PSI per la caratterizzazione delle variazioni emodinamiche cerebrali
Le esclusive caratteristiche del sistema PSI lo rendono idoneo all’analisi di piccole variazioni dinamiche nel CBF in risposta alla stimolazione, in quanto visualizza le variazioni di perfusione nello spazio e nel tempo. Risposte anomale sono segni precoci che indicano una disfunzione cognitiva.
Un frame rate e una risoluzione spaziale elevati consentono l’acquisizione di variazioni dinamiche nel microcircolo cerebrale dovute a stimoli esterni.
Immagini differenti offrono una migliore visualizzazione di variazioni più lievi nel CBF.
Accoppiamento neurovascolare (NVC)
Importante meccanismo di omeostasi che garantisce un’adeguata regolazione del CBF per incrementare la necessità di ossigeno e sostanze nutritive dei neuroni attivati, producendo un’iperemia funzionale. L’NVC ha un ruolo essenziale nel mantenimento di una sana funzione cognitiva. Il sistema PSI si utilizza per registrare le variazioni emodinamiche nella corteccia somatosensoriale in risposta a una stimolazione elettrica applicata al nervo sciatico 24 o a una stimolazione dei baffi 25-28. Una compromissione dell’NVC contribuisce al declino cognitivo dovuto all’età.
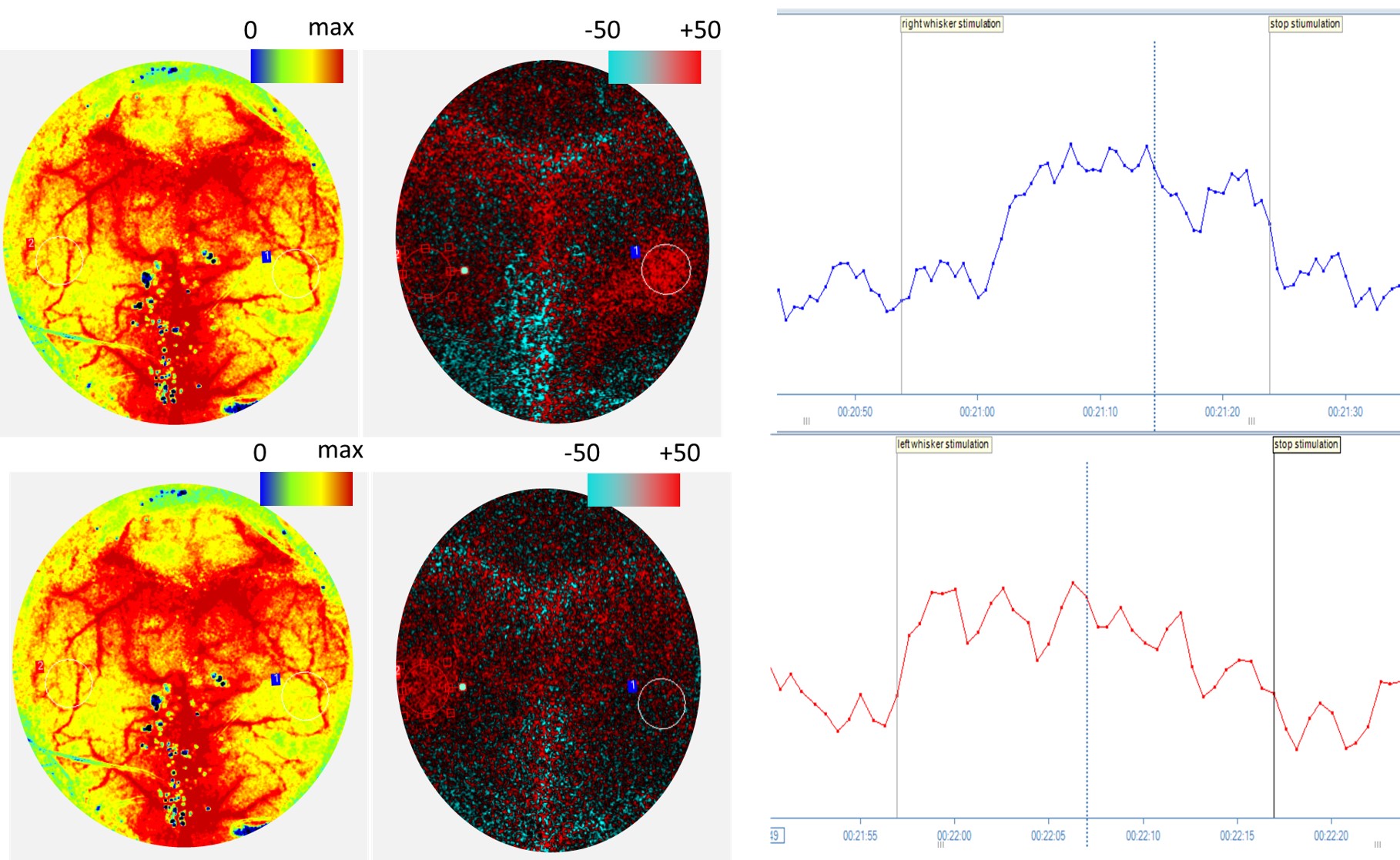
Immagini di perfusione del cervello di un topo, visualizzate sia come immagini assolute sia come immagini con differenza durante una stimolazione dei baffi di 30 secondi a destra (parte superiore) e sinistra (parte inferiore). Dati grafici PIMSoft della ROI sulla corteccia cerebrale durante la stimolazione in cui si prevede un incremento della perfusione. La disfunzione cognitiva comporta una riduzione degli incrementi della perfusione in ragione della stimolazione.
Per gentile concessione del dott. Stefano Tarantini e del dott. Zoltan Ungvari of University of Oklahoma Health Science Center, Oklahoma City, OK.
Depolarizzazione corticale propagata (CSD)
Onde di depolarizzazione transmembrana brusca e quasi completa dei gradienti di ioni della transmembrana neuronale che si propagano a una velocità di circa 3 mm/minuto nella materia grigia cerebrale, causando edema citotossico e provocando un’ischemia diffusa. La CSD è centrale per la neurodegenerazione dopo una lesione cerebrale acuta. Il sistema PSI viene utilizzato per registrare variazioni emodinamiche dovute a punture di aghi o applicazioni topiche di soluzione di potassio ad alta concentrazione 29-32.
Onde di depolarizzazione transmembrana brusca e quasi completa dei gradienti di ioni della transmembrana neuronale che si propagano a una velocità di circa 3 mm/minuto nella materia grigia cerebrale, causando edema citotossico e provocando un’ischemia diffusa. La CSD è centrale per la neurodegenerazione dopo una lesione cerebrale acuta. Il sistema PSI viene utilizzato per registrare variazioni emodinamiche dovute a punture di aghi o applicazioni topiche di soluzione di potassio ad alta concentrazione 29-32.
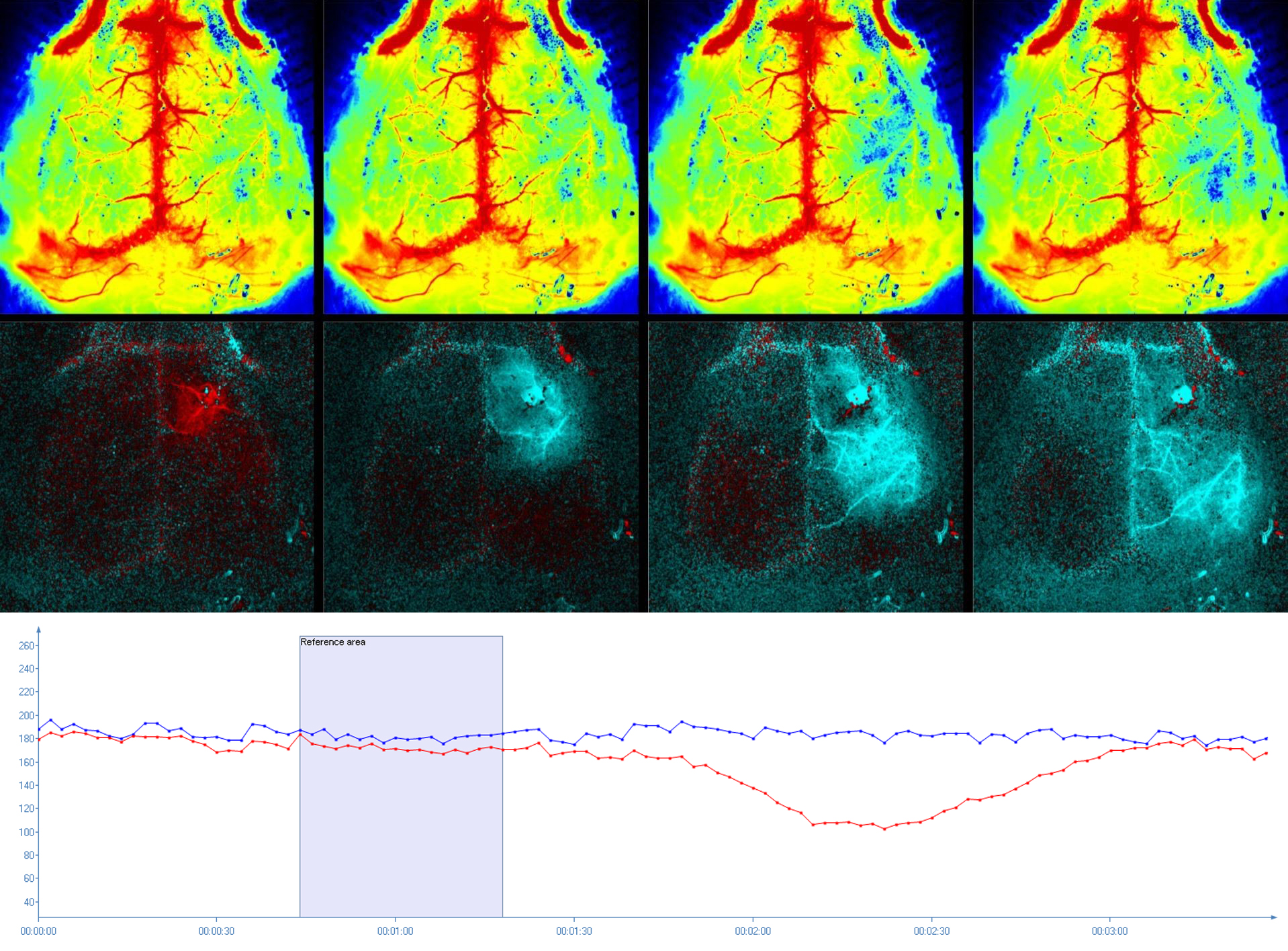
Depolarizzazione propagata nel cervello di un topo acquisita con immagini mediante PeriCam PSI HR. La perfusione assoluta (riga in alto) può essere visualizzata e quantificata (grafico) utilizzando una modalità di immagine con differenza appositamente sviluppata (riga inferiore). La variazione della perfusione causata dall’onda SD può essere seguita in modo eccellente. Per gentile concessione di Charité, Berlin, Germany.
References:
1. Morroniside promotes angiogenesis and further improves microvascular circulation after focal cerebral ischemia/reperfusion. T. Liu, B. Xiang, D. Guo, F. Sun, Re. Wei, G. Zhang, H. Aia, X.Tian, Z. Zhu, W. Zheng, Y. Wanga W.Wang. 2016, Brain Res Bull. , pp. 111-118.
2. C‐C Chemokine Receptor Type 5 (CCR5)‐Mediated Docking of Transferred Tregs Protects Against Early Blood‐Brain Barrier Disruption After Stroke. Peiying Li, Long Wang, Yuxi Zhou, Yu Gan, Wen Zhu, Yuguo Xia, Xiaoyan Jiang, Simon Watkins, Alberto Vazquez, Angus W. Thomson, Jun Chen, Weifeng Yu, Xiaoming Hu. 2017, Journal of the American Heart Association, p. e006387.
3. Endothelium-targeted overexpression of heat shock protein 27 ameliorates blood–brain barrier disruption after ischemic brain injury. Yejie Shi, Xiaoyan Jiang, Lili Zhang, Hongjian Pu, Xiaoming Hu, Wenting Zhang, Wei Cai, Yanqin Gao, Rehana K. Leak, Richard F. Keep, Michael V. L. Bennett, and Jun Chen. 2017, PNAS, Proceedings of the National Academy of Sciences, pp. E1243-E1252.
4. Brain ischemic preconditioning protects against ischemic injury and preserves the blood-brain barrier via oxidative signaling and Nrf2 activation. Tuo Yang, Yang Sun, Leilei Mao, Meijuan Zhang, Qianqian Li, Lili Zhang, Yejie Shi, Rehana K. Leak, Jun Chen, Feng Zhang. 2017, Redox Biology, pp. 323-337.
5. Brain-Derived Glia Maturation Factor β Participates in Lung Injury Induced by Acute Cerebral Ischemia by Increasing ROS in Endothelial Cells. Fei-Fei Xu, Zi-Bin Zhang, Yang-Yang Wang & Ting-Hua Wang. 2018, Neuroscience Bulletin, pp. 1077-1090.
6. The microRNA miR-7a-5p Ameliorates Ischemic Brain Damage by Repressing α-Synuclein. Kim T, Mehta SL, Morris-Blanco KC, Chokkalla AK, Chelluboina B, Lopez M, Sullivan R, Kim HT, Cook TD, Kim JY, Kim H, Kim C, Vemuganti R. 2018, Science Signaling, p. eaat4285.
7. Assessing the effects of Ang-(1-7) therapy following transient middle cerebral artery occlusion. M. M. C. Arroja, E. Reid, L. A. Roy, A. V. Vallatos, W. M. Holmes, S. A. Nicklin, L. M. Work & C. McCabe. 2019, Scientific Reports, p. 3154.
8. Modulation of brain cation-Cl− cotransport via the SPAK kinase inhibitor ZT-1a. Jinwei Zhang, Mohammad Iqbal H. Bhuiyan, Ting Zhang, Jason K. Karimy, Zhijuan Wu, Victoria M. Fiesler, Jingfang Zhang, Huachen Huang, Md Nabiul Hasan, Anna E. Skrzypiec, Mariusz Mucha, Daniel Duran, Wei Huang, Robert Pawlak, Lesley M. Foley, T. Kevin Hitc. 2020, Nature Communications.
9. Endothelium-targeted deletion of the miR-15a/16-1 cluster ameliorates blood-brain barrier dysfunction in ischemic stroke. Feifei Ma, Ping Sun, Xuejing Zhang, Milton H. Hamblin, and Ke-Jie Yin. 2020, Science Signaling.
10. Early Changes of Brain Perfusion After Subarachnoid Hemorrhage – the Effect of Sodium Nitroprusside. M Kolar, K Nohejlova, J Mares, J Pachl. 2016, Physiological Research, pp. S591-S599.
11. Changes of Cortical Perfusion in the Early Phase of Subarachnoid Bleeding in a Rat Model and the Role of Intracranial Hypertension. M Kolar, K Nohejlova, F Duska, J Mares, J Pachl. 2017, Physiological Research, pp. S545-S551.
12. Neuroprotective Effects of Nasopharyngeal Perfluorochemical Cooling in a Rat Model of Subarachnoid Hemorrhage. Mustafa Yavuz Samanci, Gennaro Calendo, Sandy T. Baker, Kadir Erkmen, Michael W. Weaver, Marla R. Wolfson. 2019, World Neurosurgery, pp. e481-e492.
13. Tauroursodeoxycholic acid prevents ER stress-induced apoptosis and improves cerebral and vascular function in mice subjected to subarachnoid hemorrhage. Xin Chen, Jianhao Wang, Xiangliang Gao, Ye Wu, Gang Gu, Mingming Shi, Yan Chai, Shuyuan Yue, Jianning Zhang. 2020, Brain Research, p. 146566.
14. TREM-2-p38 MAPK signaling regulates neuroinflammation during chronic cerebral hypoperfusion combined with diabetes mellitus. Jiawei Zhang, Yu Liu, Yaling Zheng, Yan Luo, Yu Du, Yao Zhao, Jian Guan, Xiaojie Zhang & Jianliang Fu. 2020, Journal of Neuroinflammation, Vol. 17.
15. Chronic Remote Ischemic Conditioning Is Cerebroprotective and Induces Vascular Remodeling in a VCID Model. Mohammad Badruzzaman Khan, Sherif Hafez, Md. Nasrul Hoda, Babak Baban, Jesse Wagner, Mohamed E. Awad, Hasith Sangabathula, Stephen Haigh, Mohammed Elsalanty, Jennifer L. Waller, David C. Hess. 1, 2018, Translational Stroke Research, Vol. 9, pp. 51-63.
16. Astroglial NF-kB contributes to white matter damage and cognitive impairment in a mouse model of vascular dementia. Raman Saggu, Toni Schumacher, Florian Gerich, Cordula Rakers, Khalid Tai, Andrea Delekate and Gabor C. Petzold. 4, 2016, Acta Neuropathologica Communications, Vol. 76.
17. Astrocyte-derived lipocalin-2 mediates hippocampal damage and cognitive deficits in experimental models of vascular dementia. Suk, Jae‐Hong Kim Pan‐Woo Ko Ho‐Won Lee Ji‐Young Jeong Maan‐Gee Lee Jong‐Heon Kim Won‐Ha Lee Ri Yu Won‐Jong Oh Kyoungho. 2017, Glia, pp. 1-20.
18. Cerebral microvascular dysfunction in metabolic syndrome is exacerbated by ischemia–reperfusion injury. Nathalie Obadia, Marcos Adriano Lessa, Anissa Daliry, Raquel Rangel Silvares, Fabiana Gomes, Eduardo Tibiriçá & Vanessa Estato. 67, 2017, BMC Neuroscience, Vol. 18.
19. The impact of early aerobic exercise on brain microvascular alterations induced by cerebral hypoperfusion. Marina Leardini-Tristão, Juliana Pereira Borges, Felipe Freitas, Raquel Rangel, Anissa Daliry,. 2017, Brain Research, Vol. 1657, pp. 43-51.
20. The Role of Autophagy in the Correlation Between Neuron Damage and Cognitive Impairment in Rat Chronic Cerebral Hypoperfusion. Wenying Zou, Yufei Song, Yumei Li, Yu Du, Xiaojie Zhang, Jianliang Fu. 1, 2018, Molecular Neurobiology, Vol. 55, pp. 776-791.
21. Clinical and Basic Evaluation of the Prognostic Value of Uric Acid in Traumatic Brain Injury. Liu H, He J, Zhong J, Zhang H, Zhang Z, Liu L, Huang Z, Wu Y, Jiang L, Guo Z, Xu R, Chai W, Huo G, Sun X, Cheng C. 10, 2018, International Journal of Medical Sciences, Vol. 15, pp. 1072-1082.
22. Selective activation of cannabinoid receptor-2 reduces neuroinflammation after traumatic brain injury via alternative macrophage polarization. Molly Braun, Zenab T.Khan, Mohammad B.Khan, Manish Kumar, Ayobami Ward, Bhagelu R.Achyut, Ali S.Arbab, David C.Hess, Md. Nasrul Hoda, Babak Baban, Krishnan M.Dhandapani, Kumar Vaibhav. 2018, Brain, Behavior, and Immunity, Vol. 68, pp. 224-237.
23. Evolution of cerebral perfusion in the peri-contusional cortex in mice revealed by in vivo laser speckle imaging after traumatic brain injury. Han Liu, Junchi He, Zhaosi Zhang, Liu Liu, Gang Huo, Xiaochuan Sun, Chongjie Cheng. 2018, Brain Research, Vol. 1700, pp. 118-125.
24. Regulation of cortical blood flow responses by the nucleus basalis of Meynert during nociceptive processing. Thierry Paquette, Ryota Tokunaga, Sara Touj, Hugues Leblond, Mathieu Piché. 149, 2019, Neuroscience Research, pp. 22-28.
25. Demonstration of impaired neurovascular coupling responses in TG2576 mouse model of Alzheimer’s disease using functional laser speckle contrast imaging. Stefano Tarantini, Gabor A. Fulop, Tamas Kiss, Eszter Farkas, Dániel Zölei-Szénási, Veronica Galvan, Peter Toth, Anna Csiszar, Zoltan Ungvari, Andriy Yabluchanskiy. 4, 2017, GeroScience, Vol. 39, pp. 465-473.
26. Overexpression of catalase targeted to mitochondria improves neurovascular coupling responses in aged mice. Anna Csiszar, Andriy Yabluchanskiy, Anna Ungvari, Zoltan Ungvari & Stefano Tarantini. 5, 2019, GeroScience, Vol. 41, pp. 609-617.
27. Pharmacological or genetic depletion of senescent astrocytes prevents whole brain irradiation–induced impairment of neurovascular coupling responses protecting cognitive function in mice. Andriy Yabluchanskiy, Stefano Tarantini, Priya Balasubramanian, Tamas Kiss, Tamas Csipo, Gábor A. Fülöp, Agnes Lipecz, Chetan Ahire, Jordan DelFavero, Adam Nyul-Toth, William E. Sonntag, Michal L. Schwartzman, Judith Campisi, Anna Csiszar & Zoltan Ungvari. 2020, GeroScience.
28. Treatment with the mitochondrial-targeted antioxidant peptide SS-31 rescues neurovascular coupling responses and cerebrovascular endothelial function and improves cognition in aged mice. Stefano Tarantini, Noa M. Valcarcel-Ares, Andriy Yabluchanskiy, Gabor A. Fulop, Peter Hertelendy, Tripti Gautam, Eszter Farkas, Aleksandra Perz, Peter S. Rabinovitch, William E. Sonntag, Anna Csiszar, Zoltan Ungvari. 2, 2018, Aging Cell, Vol. 17, p. e12731.
29. The antagonism of prostaglandin FP receptors inhibits the evolution of spreading depolarization in an experimental model of global forebrain ischemia. Dániel P. Varga, Írisz Szabó, Viktória É. Varga, Ákos Menhyárt, Orsolya M. Tóth, Mihály Kozma, Armand R. Bálint, István A. Krizbai, Ferenc Bari, Eszter Farkas. 2020, Neurobiology of Disease, Vol. 137, p. 104780.
30. Na+/K+-ATPase α isoform deficiency results in distinct spreading depolarization phenotypes. Clemens Reiffurth, Mesbah Alam, Mahdi Zahedi-Khorasani, Sebastian Major and Jens P Dreier. 3, 2019, Journal of Cerebral Blood Flow & Metabolism, Vol. 40, pp. 622-638.
31. Systemic administration of l-kynurenine sulfate induces cerebral hypoperfusion transients in adult C57Bl/6 mice. Dániel Péter Varga, Ákos Menyhárt, Tamás Puskás, Ferenc Bari, Eszter Farkas, Zsolt Kis, László Vécsei, József Toldi, Levente Gellért. 2017, Microvascular Research, Vol. 114, pp. 19-25.
32. Ansari MZ, Kang EJ, Manole MD, Dreier JP, Humeau-Heurtier A. Monitoring microvascular perfusion variations with laser speckle contrast imaging using a view-based temporal template method. s.l. : Microvascular Research, 2017. pp. 49-59. Vol. 111.
Compilare il modulo per ottenere maggiori informazioni
Disclaimer: è possibile che non tutti i prodotti presenti sul sito Web di Perimed siano in vendita in tutti i mercati.


